به گزارش زیستنا به نقل از ScienceAlert، سیستم ایمنی بدن ما در تشخیص تفاوت بین شیمی بدنمان و پاتوژن مهاجم توانایی دارد. هنگامی که این سیستم نادرست عمل کند، بدن ما ممکن است میزبان جنگ داخلی شدیدی شود.
دانشمندان مشتاقند تا این موضوع را با جزئیات بیشتری درک کنند و کلید تازه شناسایی شدهای که حسگر DNA خارجی را غیرفعال میکند ممکن است دیدگاههای مهمی را ارائه دهد.
بخش مهمی از این کشف را گروهی از انستیتو فناوری فدرال سوئیس لوزان انجام دادهاند و آن آنزیمی به نام سیکلیک GMP-AMP سنتاز (cyclic GMP-AMP synthase) یا به اختصار cGAS است.
این پروتئین وظیفه شناسایی ویروسهای نفوذی را بر عهده دارد. این آنزیم به هر DNA خارجی شناور خارج از محل در سیتوپلاسم سلول میچسبد و واکنشی را ایجاد میکند که بدن را نسبت به یک مهاجم آگاه میکند.
ما از پیشازاین میدانستیم که cGAS ، بهویژه هنگامیکه وارد هسته سلول میشود، باید بهشدت تنظیم شود تا تحت کنترل قرار داشته باشد. این مطالعه جدید کلیدی زیستی را شناسایی کرده است که آنزیم را برای حذف در مکانهایی که نیازی به پاسخ ایمنی نیست نشانهگذاری میکند.
پژوهشگران در مقالهای که منتشر کردهاند مینویسند: «نتایج ما در کنار برهمکنشهای پیشتر تعریفشده با نوکلئوزومها، مدل ساختاری کاملی از تنظیم هستهای cGAS را ارائه میدهد.»
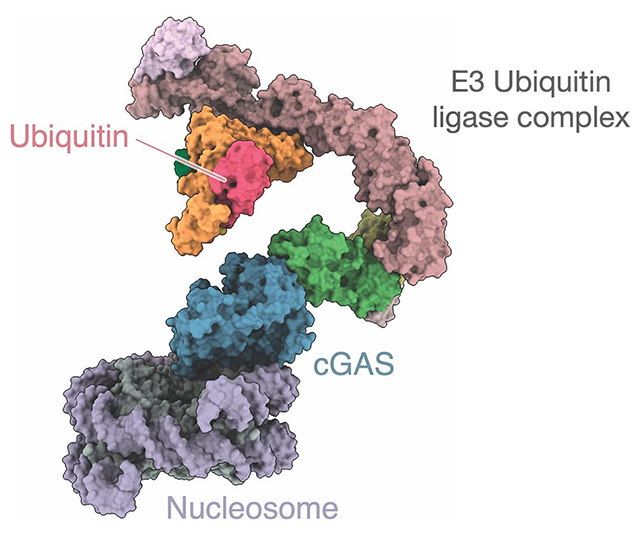
دانشمندان ثابت کردهاند که در زمان تقسیم سلول برای رشد، پوشش هستهای حل میشود. این امر سبب میشود تا cGAS به DNA بستهبندیشده در داخل هسته بهسادگی دسترسی داشته باشد. در آنجا به واحدهای بستهبندی DNA به نام نوکلئوزوم (Nucleosome) متصل میشود و بهوسیله پروتئینی به نام BAF پوشانده میشود و تا زمانی که ممکن است به آن نیاز باشد منتظر میماند.
محققان در این مطالعه، از طریق تجزیهوتحلیل دقیق سلولهای کشت داده شده در آزمایشگاه، کمپلکسی پروتئینی به نام CRL5-SPSB3 را شناسایی کردند که مادهای شیمیایی به نام یوبیکوئیتین (Ubiquitin) را به cGAS اضافه میکند تا آن را بهعنوان دفعشدنی علامتگذاری کند.
این همان کلید اصلی است که cGAS را هنگامیکه به آن نیازی نیست، یعنی زمانی که هیچ تهدیدی از جانب DNA خارجی وجود ندارد، از بین میبرد. در اصل، با خارج کردن آرام آنزیم از صحنه در حین رشد این سلولها، مانع از حمله آنزیم به سلولهای سالم میشوند.
مسیر اینترفرون (Interferon) یا IFN بخشی از پیامهایی است که پاسخ سیستم ایمنی را کنترل میکند و این مطالعه نشان میدهد که چگونه هم cGAS و هم CRL5-SPSB3، که مسئول روشن و خاموش کردن این کلید هستند، در مسیر اینترفرون نقش دارند.
پژوهشگران مینویسند: «این نتایج نشان میدهد که مقادیر cGAS هستهای بر وضعیت IFN سلولی تأثیر میگذارد و نقش CRL5-SPSB3 را در ایمنی ذاتی سلول نشان میدهد.»
اختلالات خود ایمنی، مانند دیابت نوع ۱ و بیماری التهابی روده، زمانی اتفاق میافتند که کنترلهای سیستم ایمنی آنطور که باید عمل نمیکنند. پژوهش جدید بر یکی از این کنترلها تأکید میکند که ارزش مطالعه بیشتر دارند.
اکنونکه درباره چگونگی عملکرد cGAS بیشتر میدانیم، ممکن است بتوانیم روشهای کارآمدی را ایجاد کنیم تا اطمینان یابیم که همواره بهدرستی عمل میکند.
پژوهشگران این مطالعه مینویسند: «تحقیق ما مشخص میکند که تخریب پروتئین (Protein Degradation) عاملی تعیینکننده تنظیم cGAS در هسته است و چشمانداز ساختاری را در مورد عنصری از cGAS ارائه میدهد که میتوان در درمان از آن بهره برد.»
این مطالعه در ژورنال Nature منتشر شده است.
منبع: ScienceAlert
Journal Reference:
Xu, Pengbiao, Ying Liu, Chong Liu, Baptiste Guey, Lingyun Li, Pauline Melenec, Jonathan Ricci, and Andrea Ablasser. “The CRL5–SPSB3 Ubiquitin Ligase Targets Nuclear CGAS for Degradation.” Nature ۶۲۷, no. 8005 (March 2024): 873–۷۹. https://doi.org/10.1038/s41586-024-07112-w.