به گزارش زیستنا به نقل از ScienceDaily، گروهی بینالمللی از پژوهشگران به سرپرستی دانشمندان دانشگاه علم و صنعت هنگکنگ، سازوکار جدیدی را با استفاده از فناوری ویرایش ژنوم در سراسر مغز، ایجاد کردهاند که میتواند آسیبهای بیماری آلزایمر را در موشهایی که با تغییر ژنتیکی مدل آلزایمر شدهاند کاهش دهد. این فناوری پیشرفته توانمندی بالقوه بسیار ارزشمندی را برای تبدیل بهعنوان درمانی بلندمدت برای بیماران مبتلا به آلزایمر ارائه میدهد.
تخمین زده میشود که تنها در چین، بیش از ۵۰۰ هزار بیمار با نوعی آلزایمر ارثی زندگی میکنند. این نوع از بیماری که به بیماری آلزایمر خانوادگی (FAD) مشهور است، شکلی مادرزادی از آلزایمر است که با سابقه خانوادگی ارتباط دارد. بیماری آلزایمر خانوادگی علت ژنتیکی مشخصی دارد و میتواند قبل از بروز مشکلات شناختی تشخیص داده شود، بااینوجود در حال حاضر درمان مؤثری برای آن وجود ندارد.
ویرایش ژنوم فناوری اصلاح دقیق DNA ژنومی موجود زنده با حذف، درج یا جایگزینی DNA در مکانهای خاص از ژنوم موجود است.
فناوری ویرایش ژنوم پتانسیل بسیار بزرگی بهعنوان سازوکاری درمانی برای درمان بیماریهای ناشی از جهشهای ارثی مانند بیماری آلزایمر خانوادگی دارد. بهویژه این روش برای اصلاح جهشهای ژنتیکی عامل بیماری قبل از بروز علائم مفید است، چراکه این درمان برای این بیماریها بهعنوان روشی «یکبار برای همیشه» مطرح میشود، زیرا اثرات آن میتواند در کل عمر فرد باقی بماند. بااینحال، موانع متعددی مانع از توسعه و کاربرد بالینی این روش شده است. مهمترین این موانع نبود ابزارهای مؤثر، کارآمد و غیرتهاجمی برای رساندن عوامل ویرایش ژنوم به مغز است. گذشته از این، فناوریهای موجود ویرایش ژنوم قادر به ایجاد نتایج مفید در کل مغز نیستند.
بهتازگی گروهی با هدایت پروفسور نانسی ایپ (Nancy Ip)، معاون تحقیق و توسعه دانشگاه علم و صنعت هنگکنگ، سامانه ویرایش ژنوم جدیدی ایجاد کردهاند که نهتنها از سد خونی-مغزی عبور میکند، بلکه ابزار بهینهای برای ویرایش ژنوم در کل مغز ارائه میدهد. این سازوکار با استفاده از ناقل تازه مهندسیشده برای ویرایش ژنوم و از طریق یک تزریق وریدی غیرتهاجمی، ویرایش کارآمد ژنوم در سراسر مغز را انجام میدهد. این روش بهطور مؤثری جهشهای تحمیلکننده بیماری خانوادگی آلزایمر را در مدلهای موش آلزایمر از بین میبرد و آسیبهای آلزایمر را در کل مغز بهبود میبخشد و راه را برای توسعه روشهای درمانی جدید برای این بیماری هموار میکند.
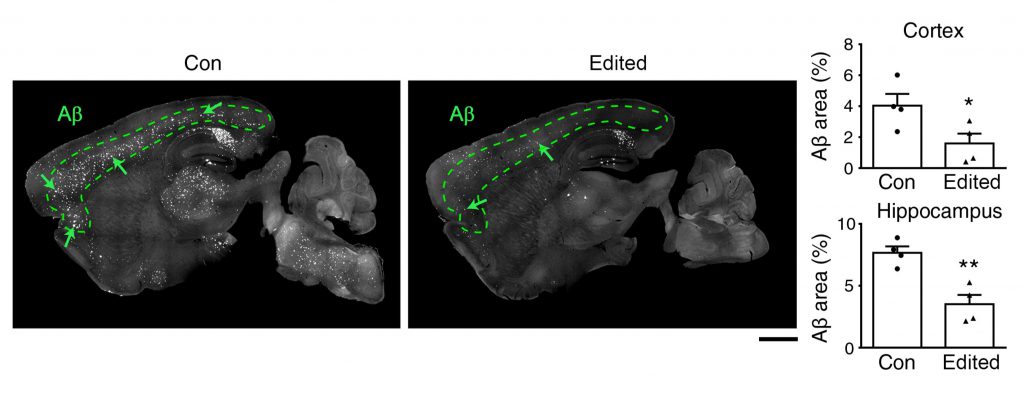
در همین حال، گروه پژوهشی در موشهای مدل دریافتند که میزان آمیلوئید، پروتئینی که تصور میشود سبب تخریب عصبی در بیماری آلزایمر میشود، به مدت ۶ ماه پس از درمان (حدود یکسوم طول عمر طبیعی موشها) پایین ماند. این مسئله نشان میدهد که این سازوکار با انجام تنها یک تزریق برای ویرایش ژنوم اثرات ماندگار دارد. مهمتر از همه اینکه تاکنون هیچ عارضه جانبی در موشها مشاهده نشده است.
پروفسور ایپ گفت: «بهعنوان اولین نمونه از ویرایش ژنوم مؤثر در کل مغز برای کاهش آسیب بیماری آلزایمر در تمام مغز، این کار واقعاً پیشرفت هیجانانگیزی است.» وی که استاد علوم زیستی و مدیر آزمایشگاه کلیدی دولتی علوم اعصاب مولکولی در دانشگاه علم و صنعت هنگکنگ است، ادامه داد: «کار ما نقطه عطفی مهمی برای بهکارگیری ویرایش ژنوم در درمان بیماریهای ارثی مغزی است و در توسعه پزشکی دقیق برای اشکال ارثی بیماریهای عصبی سهم دارد.»
این پژوهش، کار مشترکی بین دانشمندان دانشگاه علم و صنعت هنگکنگ، موسسه فناوری کالیفرنیا و موسسه فناوری پیشرفته شنزن، آکادمی علوم چین بوده است. نتایج این تحقیق بهتازگی ژورنال Nature Biomedical Engineering منتشر شده است.
منبع: ScienceDaily و دانشگاه علم و صنعت هنگکنگ
Journal Reference:
Duan, Yangyang, Tao Ye, Zhe Qu, Yuewen Chen, Abigail Miranda, Xiaopu Zhou, Ka-Chun Lok, et al. “Brain-Wide Cas9-Mediated Cleavage of a Gene Causing Familial Alzheimer’s Disease Alleviates Amyloid-Related Pathologies in Mice.” Nature Biomedical Engineering, July 26, 2021. https://doi.org/10.1038/s41551-021-00759-0.